Mekanisme Reaksi Substitusi Elektrofilik Senyawa Aromatik
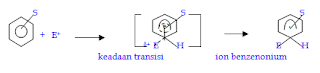
Kerapatan elektron π yang tinggi pada inti benzena dapat menyebabkan benzena dapat menarik spesies yang bermuatan positif (elektrofil), sehingga benzena mudah sekali mengalami reaksi substitusi elektrofilik. Sebagian besar reaksi substitusi elektrofilik pada senyawa aromatik berlangsung dengan mekanisme ion arenium. Dalam mekanisme ini langkah pertamanya adalah serangan elektrofil pada inti benzena menghasilkan zat – antara (intermediate) yang bermuatan positif yang disebut dengan ion benzenonium. Pada langkah kedua terjadi proses lepasnya gugus pergi dari ion benzenonium membentuk produk.
Pada mekanisme reaksi substitusi elektrofilik senyawa aromatik, jika spesies penyerang berupa ion positif (misalnya E+) , maka serangan pada senyawa aromatik (misalnya benzena) akan menghasilkan karbokation yang tahap-tahapnya adalah sebagai berikut :
Tahap – 1 :
Pada tahap ini elektrofil mengambil dua elektron dari 6 elektron π pada inti benzena dan membentuk ikatan dengan salah satu atom karbon cincin benzena. Pembentukan ikatan ini akan merombak sistem aromatik yang ada karena pada pembentukan ion benzenonium atom karbon yang membentuk ikatan dengan elektrofil berubah dari hibridisasi sp2 menjadi sp3 dan tidak lagi memiliki orbital p. Keempat elektron π ion benzenonium terdelokalisasi pada kelima orbital p.
Struktur (1), (2) dan (3) adalah struktur resonansi penyumbang pada struktur ion benzenonium yang sebenarnya. Struktur ion benzenonium yang sebenarnya merupakan hibrida dari struktur-struktur resonansi tersebut. Struktur (1) sampai dengan (3) seringkali digambarkan dengan struktur (4) sebagai berikut :
Ion arenium seringkali disebut juga dengan nama kompleks Wheland atau kompleks (sigma).
Tahap – 2 :
Pada tahap-2 ion benzenonium melepaskan proton dari atom karbon yang mengikat elektrofil. Atom karbon yang mengikat elektrofil berubah kembali menjadi hibridisasi sp2 dan inti benzena memperoleh kestabilannya kembali.
Langkah dalam tahap 2 tersebut lebih cepat daripada tahap 1, karena itu langkah penentu laju reaksinya adalah tahap 1 dan reaksinya merupakan reaksi orde kedua.
Pada Tabel 1 dapat dilihat tentang gugus-gugus yang berperan dalam reaksi substitusi elektrofilik senyawa aromatik disusun berdasarkan efek orientasi dan pengaruhnya terhadap kereaktifan inti.
Tabel 1. Efek substituen pada substitusi elektrofilik senyawa aromatik
Teori Substitusi Elektrofilik pada Senyawa Aromatik
1. Kereaktifan inti aromatik
Inti benzena yang mengikat gugus pengaktif akan bereaksi lebih cepat dalam subtitusi elektrofilik daripada benzena, sedangkan yang mengikat gugus pendeaktif akan bereaksi lebih lambat. Reaksi yang melewati keadaan transisi lebih stabil (Ea lebih rendah) berlangsung lebih cepat daripada reaksi yang melewati keadaan transisi yang kurang stabil (Ea lebih tinggi). Langkah penentu laju reaksi pada sebagian besar reaksi subtitusi elektrofilik pada benzena yang tersubtitusi adalah langkah yang mengahsilkan ion benzenonium. Jika substituen dinyatakan dengan S, maka ion benzenonium yang terbentuk oleh serangan elektrofil E+ dapat dituliskan sebagai berikut :
Dengan cara penulisan tersebut diatas berarti bahwa S dapat berposisi orto, meta atau para terhadap elektrofil E. Laju reaksi yang diakibatkan oleh adanya S tergantung apakah S menarik atau mendorong elektron. Jika S gugus pendorong elektron maka reaksi berlangsung lebih cepat daripada benzena. Sebaliknya jika S gugus penarik elektron maka reaksi berjalan lebih lambat.
2. Teori Orientasi
Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Contohnya, atom halogen lebih elektronegatif daripada atom karbon sehingga halogen memberikan efek induksi menarik elektron. Disamping itu terdapat gugus-gugus lain yang memberikan efek induksi karena adanya muatan positif atau parsial positif pada atom yang terikat pada inti benzena.
Efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi dinamakan efek resonansi. Contohnya, subtituen-subtituen nitro, siano dan karbonil bersifat pendeaktif karena menyebabkan bergesernya elektron pi pada inti benzena kearah subtituen tersebut. Akibatnya, inti benzena menjadi tuna elektron. Struktur-struktur resonansi untuk nitrobenzena dan benzaldehida digambarkan sebagai berikut :
Sebaliknya subtituen-subtituen hidroksil, metoksil dan amino bersifat pengaktif karena menyebabkan bergesernya elektron dari subtituen tersebut ke inti benzena. Akibatnya kerapatan elektron pada inti benzena bertambah besar. Struktur-struktur resonansi untuk Ar-OR dan Ar-NHR digambarkan sebagai berikut :
a. Gugus Pengarah Meta
Semua gugus pengarah meta mempunyai muatan positif atau parsial positif pada atom yang terikat langsung dengan inti benzena. Contohnaya adalah –CF3, dimana atom C pada guigus tersebut bermuatan parsial positif karena mengikat tiga atom F yang sangat elektronegatif.
Gugus –CF3 merupakan gugus pendeaktif kuat dan pengarah meta dalam reaksi subtitusi elektrofilik senyawa aromatik. gugus ini mempengaruhi kerektifan inti aromatik dengan mengakibatkan keadaan transisi yang mengarahkan pada pembentuka ion arenium yang sanagat tidak stabil. Gugus ini menarik elktron dari karbokation yang terbentuk sehingga menambah muatan posistif pada inti benzena.
Kita dapat memhami bagaimana gugus –CF3 mempengaruhi orientasi subtitusi elektrofilik jika kita mempelajari struktur-struktur resonansi ion arenium yang terbentuk oleh serangan elektrofil pada posisi orto, meta dan para dari trifluorometilbenzena.
Pada struktur-struktur resonansi ion arenium yang terbentuk oleh serangan orto dan para terlihat bahwa salah satu struktur penyumbangnya sangat tiadak stabil, karena muatan positif berada pada atom karbon inti yang mengikat gugus penarik elektron. Hal serupa tidak dijumpai pada serangan meta. Dengan demikian dapat disimpulkan bahawa ion arenium yang dibentuk oleh serangan meta paling stabil yang berarti bahawa serangan meta melalui keadaan transisi yang lebih stabil pula. Hasil eksperimen menunjukkan bahawa gugus –CF3 adalah pengarah meta yang kuat.
b. Gugus Pengarah Orto-Para
Selain substituen alkil atau fenil, semua gugus pengarah orto-para mempunyai sekurang-kurangnya satu pasangan elktron bebas (non bonding) pada atom yang terikat langsung dengan inti benzena.
Efek resonansi dapat menyebabkan efek pengarahan gugus-gugus pengarah orto-para. Efek resonansi terutama berpengaruh terhadap ion arenium yang berarti juga berpengaruh terhadap keadaan transisi yang membentuknya. Selain halogen, efek gugus-gugus pengarah orto-para terhadap kereaktifan juga disebabkan oleh efek resonansi. Seperti halnya pada efek pengarahan, efek ini juga berpengaruh terhadap keadaan transisi yang membentuk ion arenium.
Contoh efek resonansi adalah efek gugus amino (-NH2) dalam reaksi substitusi elektrofilik senyawa aromatik. Gugus amino tidak hanya merupakan gugus pengaktif kuat, tetapi juga gugus pengarah orto-para yang kuat. Efek tersebut dapat ditunjukkan pada reaksi antara anilina dengan larutan brom pada temperatur kamar dan tanpa katalis, yang mengahsilkan produk dimana semua posisi orto dan para tersubtitusi yaitu 2,4,6-tribomoanilina. Efek induksi gugus amino (-NH2) menyebabkan adanya sedikit penarikan elktron. Seperti kita ketahui bahwa atom nitrogen lebih elktronegatif daripada karbon, tetapi perbedaan keelektronegatifan tersebut tidak besar karana atom karbon pada benzena berhibridisasi sp2 yang lebih elektronegatif daripada sp3.
Dengan adanya efek resonansi ini gugus amino bersifat sebagai pendorong elektron. Efek ini dapat kita pahami dengan menuliskan struktur-struktur resonansi ion arenium yang terbentuk oleh serangan elektrofil pada posisi orto, meta dan para dari anilina.
Terdapat empat struktur resonansi pada ion benzenonium hasil serangan orto dan para, sedangkan dari serangan meta hanya tiga struktur resonansi. Hal ini menunjukkan bahwa ion benzenonium hasil serangan orto dan para lebih stabil. Tetapi hal yang lebih penting adalah kestabilan struktur-struktur penyumbang hibrida ion benzenonium hasil serangan orto dan para. Diantara struktur-struktur penyumbang tersebut ada yang memiliki ikatan ekstra yang terbentuk dari pasangan elektron bebas pada nitrogen dengan atom karbon inti. Struktur ini sangat stabil karena semua atom (kecuali atom H) memiliki elektron oktet (delapan elektron). Kestabilan struktur-struktur penyumbang tersebut menyebabkan kontribusinya terhadap hibrida resonansi lebih besar. Hal ini berarti bahwa ion benzenonium yang terbentuk dari serangan orto dan para lebih stabil daripada serangan meta. Akibatnya elektrofil bereaksi dengan cepat pada posisi orto dan para.
Halogen termasuk kelompok gugus pengarah orto-para, tetapi gugus ini mendeaktifkan inti. Kekhususan pada halogen ini dapat dijelaskan dengan asumsi bahwa efek induksinya mempengaruhi kereaktifan dan efek resonansinya menentukan orientasi. Pada senyawa klorobenzena, karena atom klor sangat elektronegatif maka diperkirakan terjadi penarikan elektron pada inti benzena dan karena itu mendeaktifkan inti benzena dalam reaksi subtitusi elektrofilik.
Jika klorobenzena diserang elektrofil, atom klor akan menstabilkan ion benzenonium yang terbentuk pada serangan orto dan para. Klor memberikan pengaruh seperti yang terjadi pada gugus amino dan hidroksi, dengan cara menyumbangkan sepasang elektron bebasnya, untuk meningkatkan kestabilan struktur-struktur resonansi bagi hibrida ion benzenonium hasil serangan orto dan para.
c. Orientasi dan kereaktifan dalam alkil benzena
Semua gugus alkil bersifat pendorong elektron dan termasuk dalam kelompok gugus pengarah orto-para, oleh karena itu mengaktifkan inti benzena dalam subtitusi elektrofilik dengan cara menstabilkan keadaan transisi yang mengarahkan kepembentukan ion benzenonium.
Pada langkah pembentukan ion benzenonium, energi pengaktifan alkil benzena lebih rendah daripada benzena sehingga reaksi pada alkil benzena berlangsung lebih cepat.
Jika serangan orto-meta dan para lewat reaksi substitusi elektrofilik pada senyawa toluena, menghasilkan struktur-struktur resonansi ion benzenonium sebagai berikut :
Pada serangan orto dan para terdapat satu struktur resonansi dimana gugus metil terikat langsung pada atom yang bermuatan positif, dan bersifat lebih stabil karena pengaruh stabilisasi gugus metil (gugus pendorong elektron) paling efektif. Struktur tersebut memberikan konstribusi hibrida ion benzenonium yang terbentuk oleh serangan orto dan para, sedangkan pada serangan meta, tidak demikian. Ion benzenonium yang terbentuk oleh serangan orto dan para lebih stabil, maka keadaan transisi yang mengarahkan kepembentukan ion benzenonium memerlukan energi lebih rendah sehingga reaksi berlangsung lebih cepat.
Persamaan Hammett
Pengarahan posisi orto, meta dan para berperan dalam persamaan hammett dimana persamaan hammett hanya berlaku pada posisi meta atau para. Persamaan Hammett tidak berlaku untuk substituen kedua pada posisi orto dikarenakan substituen pertamanya meruah sehingga substituen kedua sulit masuk adanya efek sterik yang besar (yang menghalangi posisi tersebut) serta laju reaksinya yang sangat cepat. Sehingga struktur yang meruah inilah, elektrofil masuk pada posisi setelahnya yaitu meta. Sedangkan untuk posisi para yang terjauh dari substituen pertama. Oleh karena itu pada posisi para dan meta ini laju reaksinya dapat terukur dibandingkan orto. dengan persamaan hammett.
Pertanyaan :
1. Apa pengaruhnya laju reaksi dan arah serangan terhadap hubungan antara struktur substrat dan kereaktifannnya dalam substitusi elektrofilik senyawa aromatik ?
2. Jelaskan reaksi berikut ini perbedaan gugus pendorong elektron dan penarik pada ion benzenonium ?
3. Faktor apa yang menentukan orientasi sifat-sifat gugus penarik dan pendorong elektron dalam reaksi substitusi senyawa aromatik ?
Pudjaatmaka, A. H. 1986. Kimia Organik Edisi Ketiga. Jakarta : Erlangga.
Wahyudi. 2000. Kimia Organik 3. Jakarta : Depdikbud.





















Termksh untuk materinya saya akan mencoba pertanyaan ke 3. Faktor yang dapat mentukan orientasi sifat-sifat gugus penarik dan pendorong elektron dalam reaksi substitusi senyawa aromatik yaitu: efek induksi dan resonansi. Dimana Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi dinamakan efek resonansi.
BalasHapusTerimakasih billqis
BalasHapusUntuk pertanyannya
3. Faktor yang mempengaruhi orientasi? Yaitu faktor induksi dan faktor resonansi yang dipengaruhi oleh PEB
Adanya PEB mampu mrndorong elektron sehingga bersifat aktivasi (posisi orto,para)
Pengecualian pada halogen dimana walaupun ada PEB namun cenderung menarik elektron (posisi orto,para)
Begitupun sebaliknya dimana gugus tanpa PEB akan menarik elektron (posisi meta)
Sekian :)
terimakkasih atas materinya :)
BalasHapussaya akan menjawab pertabyaan nmor 3
menurut saya faktor yang dapat mentukan orientasi sifat-sifat gugus penarik dan pendorong elektron dalam reaksi substitusi senyawa aromatik yaitu: efek induksi yang merupskan efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus dan efek resonansi,yaitu Efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi.
Saya akan menjawab pertanyaan nomor 3, yaitu efek resonansi dan induksi. Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Sedangkan efek resonansi yaitu efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi.
BalasHapusMenurut saya untuk jawaban no. 1 Hasil monosubstitusi benzena pada reaksi substitusi elektrofilik, maka substituen yang telah ada tersebut akan berpengaruh pada laju reaksi dan arah serangan. Berlangsungnya proses substitusi tersebut dapat lebih cepat atau lebih lambat daripada benzena. Sedangkan gugus baru mungkin diarahkan pada posisi orto, meta, atau para.
BalasHapusGugus-gugus yang meningkatkan laju reaksi dinamakan gugus pengaktif sedangkan gugus yang memperlambat laju reaksi disebut gugus pendeaktif. Gugus-gugus yang termasuk kelompok pengarah orto-para sebagian bersifat pengaktif dan sebagian lainnya bersifat pendeaktif, sedangkan gugus-gugus pengarah meta semuanya termasuk dalam kelompok pendeaktif. Jika suatu gugus dikatakan sebagai pengaruh orto-para tidak mutlak diartikan bahwa gugus yang baru seluruhnya diarahkan keposisi orto dan para sedangkan jawabn no. 3 Faktor yang dapat mentukan orientasi sifat-sifat gugus penarik dan pendorong elektron dalam reaksi substitusi senyawa aromatik yaitu: efek induksi dan resonansi. Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi dinamakan efek resonansi.
Terima kasih atas penjelasannya
BalasHapusMengenai pertanyaan nmr 1 yaitu
1. Hasil monosubstitusi benzena pada reaksi substitusi elektrofilik, maka substituen yang telah ada tersebut akan berpengaruh pada laju reaksi dan arah serangan. Berlangsungnya proses substitusi tersebut dapat lebih cepat atau lebih lambat daripada benzena. Sedangkan gugus baru mungkin diarahkan pada posisi orto, meta, atau para.
Gugus-gugus yang meningkatkan laju reaksi dinamakan gugus pengaktif sedangkan gugus yang memperlambat laju reaksi disebut gugus pendeaktif. Gugus-gugus yang termasuk kelompok pengarah orto-para sebagian bersifat pengaktif dan sebagian lainnya bersifat pendeaktif, sedangkan gugus-gugus pengarah meta semuanya termasuk dalam kelompok pendeaktif. Jika suatu gugus dikatakan sebagai pengaruh orto-para tidak mutlak diartikan bahwa gugus yang baru seluruhnya diarahkan keposisi orto dan para. Contohnya reaksi nitrasi pada toluena menghasilkan isomer orto = 59%, para = 37% dan meta = 4%.
Semoga bermanfaat
Terimakasih atas materi yang anda no 3. Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Sedangkan efek resonansi yaitu efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi.
BalasHapusTerimakasih atas materinya menurut saya pertanyaan nomor 3
BalasHapusFaktor yang dapat mentukan orientasi sifat-sifat gugus penarik dan pendorong elektron dalam reaksi substitusi senyawa aromatik yaitu: efek induksi dan resonansi. Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi dinamakan efek resonansi.
Say akan nencoba menjawab pertanyaan no 3
BalasHapusFaktor yang dapat mentukan orientasi sifat-sifat gugus penarik dan pendorong elektron dalam reaksi substitusi senyawa aromatik yaitu: efek induksi dan resonansi. Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Efek menarik atau mendorong elektron dari suatu gugus melalui ikatan pi dinamakan efek resonansi.